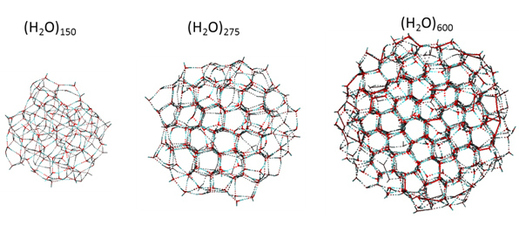
K tomu, aby vznikl ledový krystal, je zapotřebí nejméně 275 molekul vody. Toto zjištění česko-německého týmu chemiků publikoval časopis Science. Ale proč vědce něco takového vůbec zajímá? Je to důležité pro pochopení dějů v atmosféře, například vzniku ozonové díry nebo vývoje klimatu. Výzkum navíc pomáhá objasnit, kdy se z neuspořádaného shluku molekul stává jasně definovaný materiál.
" Je to překvapivý výsledek, doposud se předpokládalo, že ke krystalizaci ledu je potřeba více než tisíc molekul," říká Petr Slavíček z pražské Vysoké školy chemicko-technologické, který se na výzkumu podílel za českou stranu. Spolupracoval se čtveřicí odborníků z univerzity v Göttingenu a z Ústavu Maxe Plancka pro dynamiku a samoorganizaci.
Poznání mechanismů vedoucích ke vzniku nepatrných ledových krystalů je důležité například pro modelování atmosféry, v níž se na krystalcích a kapičkách vody odehrávají důležité chemické reakce. Například ozónová díra nad Antarktidou vzniká díky tzv. polárním stratosférickým mračnům tvořeným krystalky vody spolu s kyselinou dusičnou a sírovou. Na těchto krystalcích se z chlorovodíku uvolňují atomy chloru, které rozkládají ozón.

Vědci nestudovali krystalizaci kapalné vody, ale zaměřili se na kondenzaci amorfní a krystalické vody přímo z plynné fáze, což je proces, který v horních vrstvách atmosféry hraje významnou roli.
"O vzniku a struktuře malých vodních částic v atmosféře toho víme strašlivě málo. Experimenty v laboratoři a molekulární simulace jsou asi nejschůdnější cestou, jak se o těchto věcech něco dozvědět," říká Petr Slavíček.
Experiment navíc odpovídá na otázku, při jakém množství molekul už můžeme mluvit o "materiálu". Jedna či dvě molekuly vody se nechovají ani jako kapalina ani jako krystal. Okem viditelná dešťová kapka obsahuje více než 1021 molekul. Nový výzkum ukazuje, že jako látky známé z makrosvěta se chovají i nečekaně malé shluky molekul.
Jak vzniká nanokrystal?
Zatímco v kapalné vodě jsou molekuly nahloučené do náhodných a proměnlivých shluků, v ledu jsou uspořádány do pravidelné šestiúhelníkové struktury, což mimo jiné způsobuje, že led má větší objem než kapalná voda.
Nanočástice o malém počtu molekul se do krystalu za žádných okolností neuspořádají, molekuly se zhroutí a vytvoří amorfní kouli. Teprve od určité velikosti se uvnitř této koule začne vytvářet zárodek krystalové struktury. "První projevy krystalizace vidíme pro shluky 275 molekul vody a pro 475 molekul je už krystal prakticky hotový," říká Petr Slavíček.
Sodík místo teploměru
Krystalová struktura látek se obvykle zkoumá pomocí difrakce (ohybu) rentgenového záření. Takto je možné zjistit strukturu i velmi složitých molekul. Například struktura dvoušroubovice DNA byla v roce 1953 odhalena právě tímto způsobem.
S krystalky o pouhých několika desítkách atomů to není tak jednoduché. "Pro vodní částice klasické metody nepřicházejí v úvahu mimo jiné proto, že není možné připravit větší množství vodních nanokrystalků o stejné velikosti. Láhev s nanokrystaly si nikde nekoupíte," podotýká Slavíček.
Autoři aktuální publikace v Science na to šli jinak. Nejprve vytvořili nanokrystalky nejrůznějších velikostí, na něž "posadili" atom sodíku. Z toho lze snadno odtrhnout elektron, čímž vzniknou nabité částice. S nabitými částicemi si už molekulární fyzikové umí poradit. "Jakmile máte nabitou částici, není problém pomocí hmotnostní spektrometrie určit její hmotnost," vysvětluje pro TÝDEN.CZ Petr Slavíček. Sodík tak vědcům umožnil určit, z kolika molekul vody se ten který zkoumaný vzorek skládá.
Ale to není všechno. Sodík navíc funguje jako jakýsi nanoteploměr: elektron se z něj vyráží tím snadněji, čím je částice teplejší. Nanočástice vody je možné zahřát laserem v infračervené části spektra, přičemž platí, že ledový krystal se zahřívá jinými vlnovými délkami než amorfní voda. Díky tomu bylo možno určit, které ze vzorků krystalizovaly v led a které na to byly ještě příliš malé.
Nový přístup studia vodních nanočástic a aerosolů představuje výsledek dlouholeté spolupráce mezi göttingenskou laboratoří a pražskou teoretickou skupinou Petra Slavíčka. Pražská laboratoř se otázkám modelování chemie a fotochemie atmosférických aerosolů věnuje už několik let ve spolupráci s experimentátory z Ústavu fyzikální chemie Jaroslava Heyrovského. Na tomto ústavu, v laboratoři Michala Fárníka, jsou nyní i pomocí nové metody zkoumány vodní částice, na kterých dochází k rozkladu ozónu ve svrchních vrstvách atmosféry.










