Prostor uvnitř živé buňky je oproti prostoru vně záporně nabitý. Může za to odlišné množství různých iontů, které buňka sama aktivně řídí. Jedny z těchto iontů jsou vápenaté ionty, Ca2+. Vědci zjistili, jak je buňka pozná od ostatních. Mohlo by se to hodit při léčbě epilepsie.
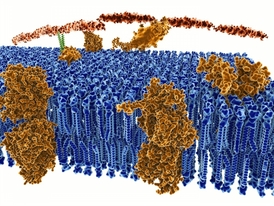
Vnitřní prostor buňky odděluje od vnějšího tenký obal, označovaný jako cytoplasmatická membrána. Tvoří ho dvě vrstvy molekul, kterým se říká fosfolipidy. Vypadají jako miniaturní medúzy. Hlava fosfolipidu je smáčivá, kdežto chapadla jsou nesmáčivá. Když se sejde víc fosfolipidů, mají sklon postavit se chapadly proti sobě. Vytvoří membránu, jejímž prostřednictvím buňka kontroluje, co se smí dostat dovnitř nebo naopak ven. Aby to ale mohla zařídit, musí dovnitř do membrány čas od času vložit i nějaký strojek, který má transport na starosti.
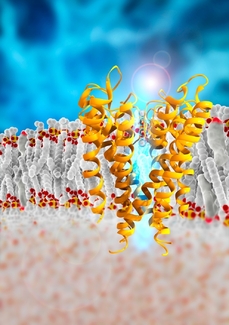
Elektrické napětí řídí struktury označované jako iontové kanály. Pouští do buňky jen určité ionty, které pak nemůžou ven. Jeden z typů těchto kanálů jsou kanály vápníkové. Vychytávají z okolí buňky vápenaté ionty Ca2+. Skupina vědců vedená Williamem A. Catterallem z Washingtonské univerzity v Seattlu zjistila, jak vápníkové kanály fungují. Podrobnosti svého objevu zveřejnili včera na webu časopisu Nature.
Účinný filtr
Na vápníkových kanálech je nejvíc udivující jejich výběrovost. Dokážou rozpoznat ion vápníku od velmi podobného iontu sodíku, který pouští do buňky jiný druh kanálů. Sodné ionty mají stejný průměr jako vápenaté. Mimo buňku, například v prostoru srdečního svalu, je jich přitom sedmdesátkrát víc než vápenatých. Přesto je vápníkové kanály rozpoznají a propustí dovnitř do buňky. Hledat příslovečnou jehlu v kupce sena zvládají úctyhodnou rychlostí. Za jednu sekundu dokážou dopravit do buňky milion vápenatých iontů.
Catterall a jeho spolupracovníci zkoumali vápníkové kanály bakterií, protože jsou přece jen jednodušší než třeba kanály savců. Transportní zařízení pro sodík i vápník vyrábí buňka každé podle jiného genu. Oba dva geny ale kdysi vznikly ze stejného předka, takže jsou si podobné.
Vědcům se podařilo změnit gen pro sodíkový kanál tak, že začal fungovat jako vápníkový. Stačilo pozměnit tři místa. Pak badatelé připravili z upravené bílkoviny krystaly a podívali se pomocí rentgenových paprsků, jak se změna projevila na jejím tvaru.
Iontová strkaná
Z tvaru proteinů pak výzkumníci odvodili, jak vápenaté ionty procházejí kanálem. K rozpoznávání, že jde opravdu o atomy vápníku zbavené dvou elektronů a ne o sodík, je nejdůležitější vstupní část proteinu. Pokud jí atom projde, dostane se na další kritické místo uvnitř kanálu, je v něm prostor jen na jeden atom. Vápenaté ionty se v něm proto dlouho neohřejí. Okamžitě je z něj vykopnou jejich další čekající pobratimové. Z posledního kritického místa se nabitý atom dostane do vnitřního prostoru buňky.
"Pohybují se tak rychle, protože se navzájem postrkují," prohlásil o iontech v kanálu Catterall. Vápníkové kanály se účastní spousty veledůležitých buněčných dějů. Zaměřují se na ně léky, jejichž pomocí lékaři léčí epilepsii, vysoký krevní tlak nebo různá srdeční onemocnění.










